在我們日常生活中,碳元素以多種形式存在著,其中最為人熟知的便是鉛筆芯中的石墨與璀璨的鉆石——金剛石。盡管它們都源自同一種元素,但這兩者的物理性質卻天差地別,從顏色、硬度到熔點,都展現出了碳元素的多樣性和神奇。
結構差異:從微觀理解宏觀差異
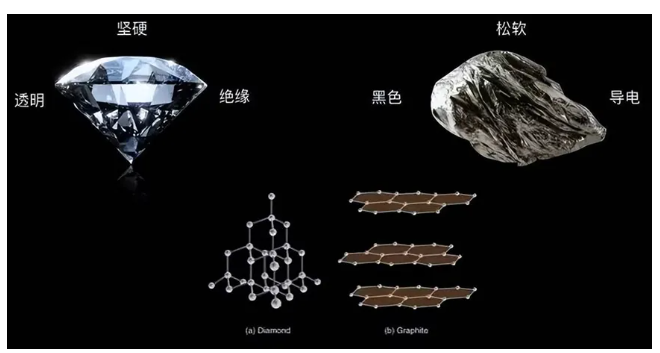
金剛石與石墨都是由碳原子通過共價鍵連接而成,但它們的排列方式截然不同。金剛石硬度比石墨大得多,緣于金剛石中的碳原子以四面體結構排列,每個碳原子都與四個其他碳原子相連,形成了極其堅硬且均勻的空間網狀結構。無論從哪個方向施加外力,都需要同時破壞大量的共價鍵才能才能使其變形或破裂。
相比之下,石墨的結構則顯得“松散”許多。石墨中的碳原子呈層狀排列,每一層內的碳原子通過共價鍵緊密相連,形成六邊形網格,而層與層之間則通過較弱的范德華力相互連接。層與層之間距離過大、作用力太弱,容易被“各個擊破”——先被輕易地“搓開”成極薄的一層層,再被外力輕易破壞掉微觀的層內結構。這種層狀結構賦予了石墨良好的潤滑性和可塑性,使得它易于被切割和塑形,硬度遠低于金剛石。
從石墨到金剛石:人工合成的奇跡
鑒于金剛石與石墨的巨大差異,科學家們長期以來致力于探索從石墨合成金剛石的方法。從莫瓦桑的高溫電爐嘗試,到后來的爆炸法、氣相沉積法,再到現代的高溫高壓法,每一次技術的革新都標志著人類對碳材料理解的深入和技術能力的提升。尤其是氣相沉積法和高溫高壓法,前者通過精確控制碳原子的沉積過程,能在特定基底上生長出金剛石薄膜或晶體;后者則在高溫高壓條件下,利用觸媒的催化作用,使石墨轉化為大顆粒的金剛石,應用于工業切割工具和珠寶。
硬度與熔點的反常:金剛石為何熔點低?
從微觀角度來看,熔化意味著構成物質的粒子在三維空間中獲得自由度,能夠自由流動。對于金剛石和石墨來說,這種自由度的獲得需要同時破壞大量的共價鍵,因此它們的熔點都非常高。
對于絕大多數晶體而言,一般硬度大則熔點高。而在金剛石與石墨這里則出現了硬度與熔點不一致的情況。
盡管金剛石以其無與倫比的硬度著稱,但在熔點這一物理性質上,它卻意外地低于石墨。這背后的原因與它們的共價鍵強度和結構特性密切相關。金剛石中的碳原子采用sp3雜化,形成的共價鍵鍵長較長(0.155nm),鍵能相對較低;而石墨中的碳原子采用sp2雜化,鍵長較短(0.142nm),鍵能較高。因此,當這兩種材料從固態轉變為液態時,盡管都需要破壞大量的共價鍵,但石墨中更強的共價鍵需要更高的能量才能斷裂,從而導致了石墨的熔點高于金剛石(石墨熔點3680℃,金剛石熔點3550℃)。

石墨和金剛石的導熱性能
石墨是一種導熱性能優良的材料,其導熱系數遠高于許多常見材料。石墨的導熱系數范圍通常很高,但具體數值會因石墨的品質和測試條件的不同而有所差異。
石墨的層狀結構是其高效導熱的關鍵所在,層內碳原子通過強共價鍵緊密結合,形成穩定的結構,有利于熱量的快速傳遞。然而,由于層間通過較弱的范德華力相連,石墨在層間方向上的導熱性能相對較弱。盡管如此,石墨仍被廣泛用作高溫環境下的熱管理材料,如散熱片、導熱膜等,其優良的導熱性能和化學穩定性在這些應用中發揮了重要作用。
對于金剛石來說,盡管金剛石是絕緣體,不含自由電子,但它卻擁有所有固體中最佳的導熱性能。其熱導率在自然界中名列前茅。?在常溫下,金剛石的熱導率可達2000~2200 W/(m·K),這一數值是銅和銀的4~5倍,比碳化硅(SiC)大4倍,比硅(Si)大13倍,比砷化鎵(GaAs)大43倍。此外,IIa型金剛石在液氮溫度下的熱導率可以達到銅的25倍,表現出超導熱性。金剛石的化學性質穩定,耐酸堿,高溫下不與某些化學物質反應,這些特性使其在極端環境下也能保持良好的導熱性能。
金剛石結構中不存在自由電子,怎么會具有導熱性呢?原來,導熱與導電的本質是有所不同的,這是由熱的微觀本性決定的——熱的微觀本質是微粒的運動,微觀粒子運動速率快,則外在表現為溫度高,微觀粒子的這種運動可以是自由的、無規則運動,也可以是在晶格上發生的自身振動。可以想象,金剛石的優良導熱性,正是靠晶格上碳原子自身的振動來實現的。由于金剛石晶格排列的高度有序,加之其振動頻率跟熱(本質上是一種電磁波)傳導要求的頻率高度一致,使得碳原子的這種振動在晶體內很容易引發共振,從而迅速地將熱量從一處傳導至另一處,于是金剛石成為導熱性最好的固體物質。
這種獨特的導熱性能使得金剛石在高科技領域有著廣泛的應用。例如,在半導體芯片封裝中,金剛石能夠迅速傳導熱量,避免芯片因溫度過高而性能下降或可靠性降低。此外,金剛石還用于制造高功率電子器件的散熱片和高導熱界面材料,因其高導熱率和低熱膨脹系數,能夠有效降低材料在溫度變化時的尺寸變化,提高設備的穩定性和可靠性。

金剛石與石墨作為碳元素的同素異形體,通過其獨特的微觀結構展現了截然不同的宏觀性質。從它們的相互轉化到反常的物理特性,每一項發現都是對自然界奧秘的深刻揭示,也是人類智慧和技術進步的見證。


 手機資訊
手機資訊 官方微信
官方微信








 豫公網安備41019702003604號
豫公網安備41019702003604號